Ocena ryzyka jest procesem opartym na podstawach naukowych, którego celem są systematyczne zestawienie i analiza aktualnych danych i wiedzy na temat ryzyka. W idealnej sytuacji proces ten powinien prowadzić do obiektywnej oceny prawdopodobieństwa i wpływu niepożądanego skutku na zdrowie i życie konsumenta. Ocena ryzyka opiera się na opublikowanych badaniach naukowych, raportach z nadzoru, danych branżowych oraz w razie potrzeby, osądach ekspertów uzyskanych przy użyciu odpowiednich metod. Etapy wymagane w ocenie ryzyka: identyfikacja zagrożenia, ocena narażenia, charakterystyka zagrożenia i analiza dawka-odpowiedź, charakterystyki ryzyka.
Identyfikacja zagrożenia
W przypadku dobrze znanych zagrożeń mikrobiologicznych identyfikacja zagrożenia to proces jakościowy np. ustalający związki między zagrożeniem mikrobiologicznym a niektórymi grupami wysokiego ryzyka w populacji. Inaczej jest w przypadku identyfikacji niepoznanego zagrożenia. Postępowanie identyfikacji zagrożenia wymaga rozpatrzenia kilku aspektów dotyczących rodzaju, rozmiaru i szczegółu problemu (Tab.1). Identyfikacja zagrożeń, która zazwyczaj obejmuje ocenę danych epidemiologicznych. Na tym etapie procesu analizowane są takie kwestie, jak ostre i przewlekłe choroby, wrażliwe populacje i inne komplikacje, takie jak długoterminowe następstwa. Podczas tego wstępnego etapu należy również rozpoznać cechy mikroorganizmu i jego działanie, podkreślając sposób, w jaki mikroorganizm wpływa na konsumenta zarówno w żywności przed spożyciem, jak i po spożyciu w jelicie, lub alternatywnie poprzez mechanizmy zakaźne.
Zasadniczo, etap identyfikacji zagrożenia jest w dużej mierze jakościową oceną dostępnych informacji i służy udokumentowaniu ważnych informacji znanych na temat:
– patogenu,
– produktu spożywczego,
– konsumenta.
Pałeczki Listeria monocytoegenes (rodzina Listeriaceae, rząd Bacillales, typ Firmicutes) zostały opisane przez Murraya w 1926 roku i początkowo uchodziły za patogen zwierząt. Jednak znacząca liczba przypadków i ognisk epidemiologicznych zanotowana w latach siedemdziesiątych i osiemdziesiątych ubiegłego wieku w Ameryce Północnej i Europie spowodowały, że bakteria została oficjalnie zakwalifikowana jako patogen ludzki.
Bakterie z rodzaju Listeria klasyfikowane są jako pałeczki (proste, cylindryczne), gram-dodatnie, nie tworzące endospor, względnie beztlenowe oraz psychrotrofowe. Cechą, która jest charakterystyczna dla wszystkich bakterii z rodzaju Listeria jest zdolność do ruchu w temperaturze 25°C oraz fakt, że są oksydazo-ujemne i katalazo-dodatnie. Podstawą do odróżniania poszczególnych gatunków są inne właściwości: zdolność do fermentacji cukrów oraz właściwości lityczne w stosunku do erytrocytów różnych gatunków zwierząt. Wykazują hemolizę typu beta, chociaż nieliczne szczepy mogą nie posiadać zdolności rozkładu krwinek. Wyodrębniono dotychczas 14 serotypów L. monocytogenes (1/2a, 1/2b, 1/2c, 3a, 3b, 3c, 4a, 4ab, 4b, 4c, 4d, 4e, 4h, 7). Najgroźniejsze dla człowieka i najczęściej izolowane z żywności są serotypy L. monocytogenes 4b, 1/2a, 1/2b, 1/2c powodując ponad 95% przypadków listeriozy i stanowiąc ponad 95% izolatów z produktów spożywczych. Serotyp 1/2a jest najczęściej izolowany z żywności, podczas gdy serotyp 4b jest odpowiedzialny za zakażenia ogólne i pochodzi z materiału klinicznego.
W przypadku Listeria monocytogenes ustalono związek przypadków listeriozy z przynależnością osoby do grup ryzyka, tzw. YOPI (z ang. Young, Old, Pregnant, Immunocompromised). Do grup ryzyka zalicza się w populacji osoby z zaburzoną odpornością (osoby z chorobami nowotworowymi, po przeszczepach), osoby starsze oraz kobiety w ciąży, ale też alergików, diabetyków i dzieci. Infekcje pokarmowe, których przyczyną jest L. monocytogenes są szczególnie częste u niemowląt i osób powyżej 60 roku życia. W grupie wiekowej pomiędzy 10 a 40 rokiem życia, aż 60% przypadków infekcji dotyczy kobiet ciężarnych. Szacuje się, że od 5 do 10% populacji to bezobjawowi nosiciele bakterii.
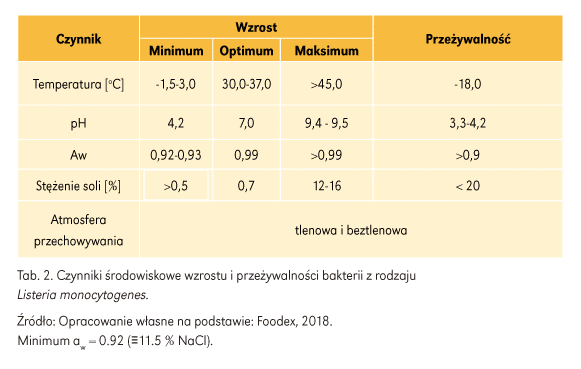
Do zakażeń bakterią L. monocytogenes dochodzi najczęściej drogą pokarmową. Nośnikiem zakażenia jest zanieczyszczona żywność lub woda. Badania wykazały, że komórki L. monocytogenes częściej izolowane są z przestrzeni produkcyjnej (powierzchnia urządzeń, maszyn oraz ścieki) niż z surowców. Bakteria ta posiada szczególne właściwości, które sprawiają, że stanowi ona wyjątkowe zagrożenie mikrobiologiczne, należą do nich: wysoka zdolność adhezji do różnych powierzchni, niska wrażliwość na działanie środków dezynfekujących, szeroki zakres odporności na warunki środowiska-wzrost w temperaturze chłodniczej, ale także temperaturze pokojowej i powyżej 30-37°C do nawet 45oC. Całkowita inaktywacja bakterii tego gatunku następuje w temperaturze powyżej 75oC oznacza to, że L. monocytogenes jest w stanie przeżyć niską pasteryzację, znosi duże wahania pH (4,2 – 9,5), suszenie oraz duży dodatek soli. Może wzrastać w środowisku o 10% zawartości NaCl w 35°C i 12% zawartości NaCl w 25°C. Ponadto bakteria ta może wzrastać w atmosferze o dużej koncentracji (np. 30%) CO2, co sprzyja jej rozwojowi w żywności pakowanej w MAP, ale jest inhibowana w atmosferze 100% CO2.
Wybrane czynniki, które wpływają na wzrost i przeżywalność L. monocytogenes przedstawiono w tabeli 2. Wśród produktów, z których najczęściej izolowano bakterie wymienia się: produkty przetworzone, produkty garmażeryjne, wędzone ryby i przetwory rybne, niepasteryzowane mleko, sery dojrzewające – głównie miękkie i półmiękkie, surowe owoce i warzywa.
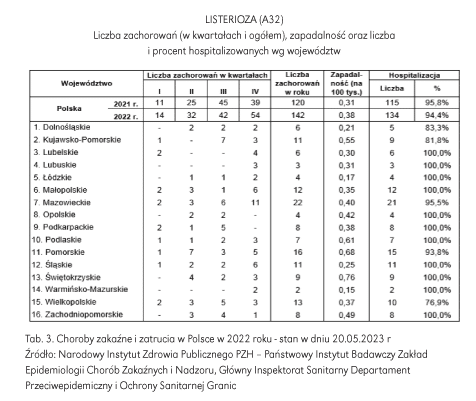
Liczba przypadków listeriozy w Polsce sukcesywnie rośnie. Na przestrzeni ostatnich 10 lat zanotowano podwojenie liczby hospitalizowanych przypadków listeriozy, w latach 2011-2012 zanotowano 54 przypadki, natomiast w latach 2021 i 2022 odpowiednio 115 i 134 przypadków (Tab. 3). Zgodnie z danymi Narodowego Instytutu Zdrowia Publicznego w latach 2005-2009 notowano średnio rocznie 33 zachorowania, natomiast odpowiednio w latach 2021-2022 notowano rosnącą liczbę przypadków: 120 i 142.
Ocena narażenia
Ocena narażenia przede wszystkim dotyczy oszacowania prawdopodobieństwa narażenia na zagrożenie za pośrednictwem rozważanego produktu spożywczego oraz ilości lub dawki, na którą narażona jest populacja lub jednostka. Ocena ryzyka mikrobiologicznego to proces znacznie bardziej dynamiczny w porównaniu z tradycyjną oceną ryzyka chemicznego. Przyczyną jest możliwość namnażania się drobnoustrojów w żywności. Z kolei oceny związane z narażeniem na toksyny drobnoustrojowe muszą uwzględniać kombinację cech drobnoustrojów i chemicznego działania samej toksyny.
Na tym etapie należy oszacować częstość występowania i zakres zanieczyszczenia mikrobiologicznego produktu w momencie konsumpcji, prawdopodobieństwo, że dana osoba spożywa określony produkt spożywczy w danym okresie, okoliczności, w których żywność została skonsumowana (przygotowana w domu vs. instytucjonalna lub gastronomiczna itp.) oraz ilość produktu spożywanego podczas każdego posiłku.
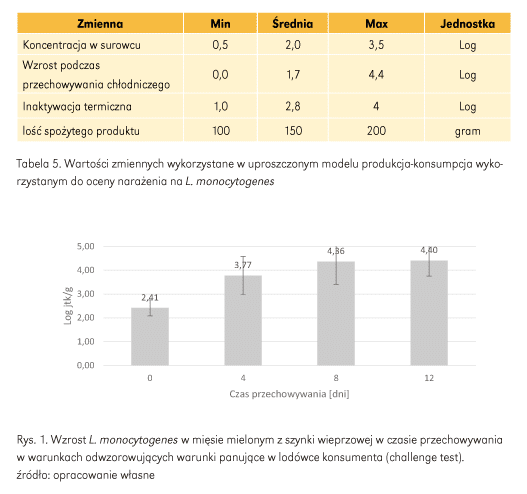
Ponieważ nie jest możliwe dokładne zmierzenie populacji patogenu obecnego w żywności w momencie spożycia, należy opracować modele lub założenia w celu oszacowania prawdopodobnego narażenia. W przypadku bakterii należy uwzględnić wzrost i śmierć mikroorganizmu w żywności oraz w ramach przewidywanych praktyk obsługi i przygotowania (Tab. 4 i Tab. 5). Temperatura, czas, skład chemiczny żywności i konkurencyjna mikroflora mogą wpływać na tempo wzrostu i śmierci patogenów. W przykładzie (Tab. 5) zakłada się, że w mięsie koncentracja patogenu wynosi od minimum 0,5 log jtk/g do maksimum 3,5 log jtk/g, przy średniej liczbie 2,0 log jtk/g. W przechowywaniu chłodniczym zakłada się wzrost patogenu od 0 do 4,4 log jtk/g spowodowany wystąpieniem przerw w łańcuchu chłodniczym i nieefektywnym chłodzeniem (Rys. 1). Wreszcie, produkt jest poddawany obróbce termicznej, co powoduje redukcję od 1 do 4 log jtk/g, a konsument spożywa od 100 do 200 gramów porcji produktu.
Gdyby zastosować podejście punktowe, można użyć średnich wartości zmiennych wejściowych, takich jak 2,0 log jtk/g dla stężenia i 2,83 log jtk/g inaktywacji podczas obróbki termicznej. Te szacunki punktowe są następnie wykorzystywane do obliczenia „najlepszego oszacowania” liczby organizmów spożytych przez konsumenta
= 10[ 2,0 + 1,7 – 2,8] × 150 = ok. 1 485 komórek.
Analizę punktową można kontynuować, wykorzystując maksymalne i minimalne szacunki punktowe każdej ze zmiennych do obliczenia możliwych wyników w oparciu o różne kombinacje koncentracji, redukcji spowodowanych obróbką termiczną i spożywanych ilości. W prostym przykładzie pokazanym powyżej istnieją 84 różne możliwe kombinacje. Jest mało prawdopodobne, aby wszystkie możliwe warianty zostały ocenione. Zastosowanie podejścia opartego na szacunkach punktowych, pozwala wyznaczyć granice i wiedzieć, że wszystkie wartości między tymi granicami są możliwe. W tym przykładzie maksymalna możliwa dawka, która może zostać spożyta, występuje, gdy początkowa koncentracja patogenu jest maksymalna, wzrost zachodzący podczas chłodzenia jest maksymalny, inaktywacja zachodząca podczas obróbki termicznej jest minimalna i spożywane są największe porcje. Korzystając z tych wartości, szacujemy spożycie patogenu wynosi około 6,3e+8 komórek jako „najgorszy scenariusz”. Należy zauważyć, że tego rodzaju szacunki stają się coraz trudniejsze, gdy model staje się bardziej złożony. Zatem jedną z wad oceny punktowej jest trudność zastosowania w modelach uwzgledniających więcej zmiennych. Ponadto w tym podejściu szacowania ryzyka prawdopodobieństwo rzeczywistego wystąpienia jest ignorowane. Wszystkie wartości pomiędzy minimalnym i maksymalnym punktem są uważane za równie prawdopodobne. W rzeczywistości jednak niektóre wartości z przedziału są bardziej prawdopodobne niż inne. Korzystając z powyższego przykładu, chociaż może być prawdą, że konsumenci jedzą od 100 do 200 gramów produktu, istnieje niewielki odsetek osób, które jedzą skrajne ilości i że rzeczywisty wzorzec konsumpcji jest inny, zgodny z rozkładem statystycznym np. rozkładem normalnym.
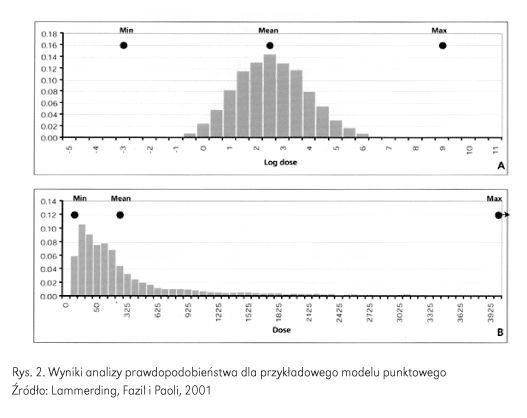
Z rozkładu prawdopodobnych ekspozycji (Rys. 2A) łatwo zauważyć, że gdy do uzyskania punktowego oszacowania maksymalnej przyjętej dawki zastosuje się scenariusz „najgorszego przypadku”, szacowana wartość jest wysoka (8,8 log, czyli 6,3e8 jtk/g), ale prawdopodobieństwo wystąpienia jest niezwykle rzadkie.
Na rysunku 2B oś x jest wykreślona w skali innej niż logarytmiczna. Korzystając z tej skali, bardzo niskie prawdopodobieństwo wystąpienia „najgorszego scenariusza” staje się jeszcze bardziej oczywiste, gdyż biorąc pod wagę, że punkt oznaczony na rysunku jako „Max” w rzeczywistości znajdowałby się daleko po prawej stronie wykresu.
Matematyczny opis produkcji i konsumpcji żywności przy użyciu rozkładów prawdopodobieństwa jest bardzo trudny do analitycznego obliczenia. Niektóre analizy są możliwe w przypadku małych i prostych modeli. Złożony model produkcji żywności obejmujący wzrost, niszczenie i przeżywalność patogenów jest często zbyt złożony, aby można go było rozwiązać analitycznie. Wówczas konieczne staje się zastosowanie metod symulacyjnych w celu rozwiązania modeli matematycznych. Analiza Monte-Carlo jest matematycznym narzędziem symulacyjnym dobrze nadającym się do rozwiązywania stochastycznych modeli symulacyjnych.
Charakterystyka zagrożenia i analiza dawka-odpowiedź
Charakterystyka zagrożenia obejmuje jakościowy lub ilościowy opis niekorzystnych skutków, nasilenia i czasu trwania niepożądanych skutków, które mogą wynikać ze spożycia mikroorganizmu z żywnością (tab. 6).
Nie określono dawki zakaźnej L. monocytogenes, gdyż jest to uzależnione od właściwości patogennych danego szczepu. Niektórzy badacze wskazują, że ostre dolegliwości: krwawa biegunka czy nieżyt żołądka i jelit występują przy inokulum większym niż 109 jtk/g produktu. Natomiast w przypadku osób wrażliwych do wywołania choroby wystarczy mniej niż 13 jtk/g/ml produktu. Kliniczna postać infekcji bakteriami z rodzaju Listeria zależy od trzech głównych czynników: liczby bakterii przyjętych z pokarmem, patogennych cech szczepów związanych z rodzajem serotypu, immunologicznego statusu chorego.
Mimo szczególnego nadzoru nad produkcją żywności L. monocytogenes wciąż jest dużym zagrożeniem. Przypadki listeriozy, choroby powodowanej przez L. monocytogenes, są odnotowywane na całym świecie: w Afryce, Australii i Oceanii, Ameryce Południowej, Ameryce Północnej, Europie i Azji. W USA listerioza jest trzecią pod względem liczby przypadków przyczyną zatruć pokarmowych ze skutkiem śmiertelnym.
Pierwsze objawy infekcji u osób dorosłych są niespecyficzne, występują po 24-48 godzinach i należą do nich: bóle stawów i głowy, biegunka, senność. Objawy te zwykle samoistnie ustępują, jednak u osób z grupy podwyższonego ryzyka dochodzi do listeriozy, która może mieć przebieg bakteriemii, prowadzącej do zniszczenia narządów wewnętrznych, a w konsekwencji do śmierci w następstwie:
– zapalenia opon mózgowo-rdzeniowych i mózgu. Zakażenie ośrodkowego układu nerwowego w 50% przypadków kończy się śmiercią chorych. Ze wszystkich znanych bakteryjnych czynników etiologicznych zapalenia opon mózgowych, to właśnie przypadki spowodowane przez L. monocytogenes cechują się największą śmiertelnością. Wyróżnia się dwie postacie zapalenia opon mózgowo-rdzeniowych i mózgu:
– zapalenia opon mózgowo rdzeniowych objawiające się sztywnieniem karku, bólami głowy, podwyższoną temperaturą ciała, zaburzeniami ruchowymi czy napadami padaczkowymi. Śmiertelność tego schorzenia kształtuje się na poziomie ok. 22%; – zapalenie tyłomózgowia objawiające się bólami głowy, nudnościami, wymiotami, bezwładem ruchowym spowodowanym uszkodzeniem nerwów czaszkowych czy zaburzeniami świadomości. Śmiertelność tej formy listeriozy kształtuje się na poziomie ok. 50%;
– zakażenia wątroby jako następstwo bakteriemii dotyczy głównie osób chorych na cukrzycę, marskość wątroby czy osób z chorobą alkoholową. Charakteryzuje się wysoką śmiertelnością – 50% przypadków;
– zakażenia wsierdzia – ten rodzaj zakażenia notuje się stosunkowo rzadko (7,5%) i głównie dotyczy pacjentów ze sztuczną zastawką serca;
– listeriozowego zapalenia spojówek oraz zakażenia skóry – diagnozowane głównie u pracowników laboratorium czy weterynarzy, którzy nie przestrzegają reżimów higienicznych.
Listerioza u kobiet ciężarnych może przybierać różną postać, występuje dość często (stanowi 27% wszystkich przypadków listeriozy) i może mieć różny przebieg.
– postać listeriozy kobiety ciężarnej – choroba matki przebiega zwykle łagodnie (objawy grypopodobne), zdarzają się nawet bezobjawowe przypadki zakażeń. Jednak konsekwencją listeriozy u kobiety ciężarnej może być zakażenie płodu, co może prowadzić do poronienia.
– postać listeriozy okołoporodowej wczesnej – zakażenie wewnątrzmaciczne, skutkuje przedwczesnym porodem. L. monocytogenes pokonuje m. in. barierę łożysko-płód, dlatego szczególnie w tej postaci listeriozy narażone jest dziecko. Rozwijająca się bakteriemia u matki może doprowadzić do tzw. wczesnego zakażenia płodu (I i II trymestr), którego konsekwencją jest zwykle poronienie, urodzenie martwego dziecka lub zbyt wczesny poród. W przeciągu 48 godzin od zakażenia można zaobserwować typowe objawy: zmiana barwy wód płodowych, problemy z oddychaniem, a nawet tworzenie się ziarniaków w mózgu.
– postać listeriozy okołoporodowej późnej – występuje, jeśli do zakażenia dojdzie w późniejszym etapie ciąży (III trymestr). W tym przypadku stwierdza się wrodzoną listeriozę noworodka. Do zakażenia dziecka może dojść zarówno w macicy jak i w trakcie trwania porodu podczas przechodzenia dziecka przez drogi rodne. Zakażenie donoszonego dziecka może doprowadzić do chorób neurologicznych dziecka, a nawet zgonu. Zarówno zakażenia płodów, jak i zakażenia noworodków charakteryzują się ostrym przebiegiem i wysoką śmiertelnością. Noworodki zainfekowane tą bakterią chorują na zapalenie opon mózgowych, sepsę oraz zapalenie płuc.
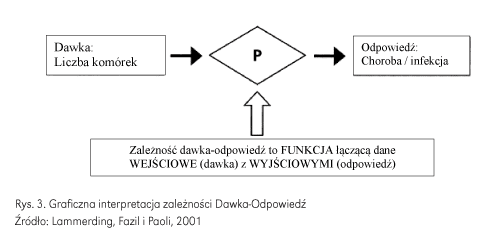
Ilościowe podejście do etapu – charakterystyka ryzyka – można przedstawić jako analizę dawka-odpowiedź. Zależność dawka-odpowiedź próbuje oszacować prawdopodobieństwo wystąpienia choroby po narażeniu na zagrożenie jako oszacowanie skali niekorzystnych skutków dla indywidualnego konsumenta lub populacji (rys. 3). Charakterystyka zagrożenia stanowi również miarę oceny wartości wysiłków na rzecz bezpieczeństwa żywności np. zmniejszenie liczby osób chorujących i/lub intensywności przebiegu choroby w wyniku interwencji (tab. 7).
Ogólne prawdopodobieństwo wystąpienia choroby zależy od wystąpienia trzech prawdopodobieństw warunkowych:
– Prawdopodobieństwo, że patogen zostanie połknięty (jest to wynik oceny narażenia oraz całego modelowania i szacunków poprzedzających odpowiedź na dawkę).
– Prawdopodobieństwo, że mikroorganizm jest w stanie przeżyć i zarazić żywiciela po spożyciu.
– Prawdopodobieństwo zachorowania żywiciela po zakażeniu.
Proces chorobowy powodowany przez drobnoustroje, który scharakteryzuje analiza dawka-odpowiedź, zależy od:
– Charakterystyki samego organizmu, np. mechanizmu patogenezy, czynników wirulencji i odporności na czynniki gospodarza, takie jak kwasowość żołądka i odpowiedź immunologiczna.
– Podatności gospodarza, np. odporności lub stanu odżywienia.
– Charakterystyka żywności, w której przenoszony jest patogen, np. żywność o wysokiej zawartości tłuszczu chroni organizm przed kwasowością żołądka.
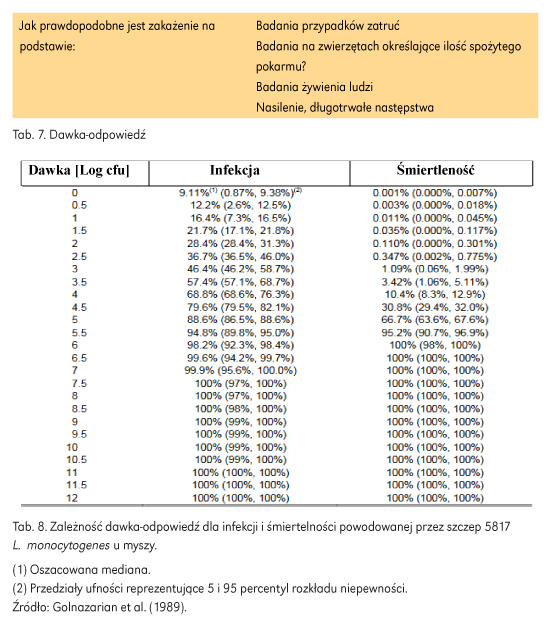
Dane do sformułowania zależności dawka-odpowiedź mogą pochodzić z kilku źródeł (tab. 7). Najczęściej do opisania tej zależności wykorzystuje się dane z badań na ludziach. Jednak ze względów etycznych, zwłaszcza w przypadku wysoce zjadliwych patogenów, dostępność tego rodzaju danych jest ograniczona. Drugie źródło danych to wyniki analiz badań żywieniowych na zwierzętach. Ten rodzaj danych wymaga wyprowadzenia współczynnika konwersji lub translacji, który pozwoli na zastosowanie szacunków do odpowiedzi u ludzi (tab. 8). Źródłem danych, które również można wykorzystać, są dane epidemiologiczne. Dane dotyczące epidemii są wyjątkowo użyteczne, ponieważ zazwyczaj obejmują przekrój populacji lub przynajmniej członków populacji ogólnej. Jest to przeciwieństwo danych z badań żywieniowych, które zazwyczaj obejmują zdrowych ochotników płci męskiej (być może najmniej podatny segment populacji). Wyjątkowe w przypadku danych pochodzących z epidemii, jest to, że są generowane każdego dnia na całym świecie. Dane są gromadzone na temat dawki i odsetka populacji, która zjadła skażoną żywność i zachorowała, wówczas baza danych informacji dawka-odpowiedź może być stopniowo kompilowana i ostatecznie wykorzystana do lepszego zrozumienia krzywej dawka-odpowiedź.
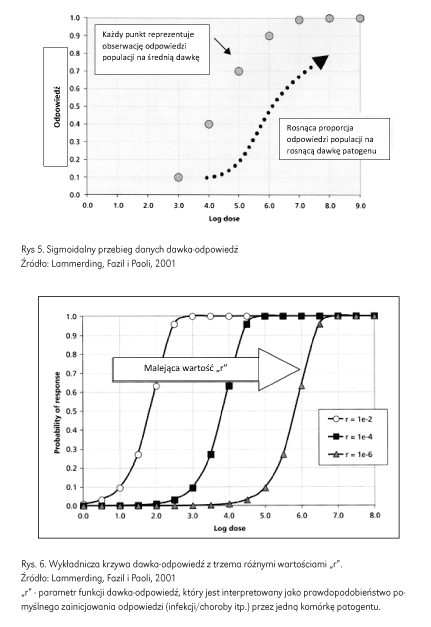
Zazwyczaj przebieg danych dawka-odpowiedź ma kształt sigmoidalny dlatego można zastosować dowolną z wielu funkcji matematycznych, które wykazują tego rodzaju kształt (rys. 5).
Korzystając z tych założeń, wyprowadzono wykładniczą, bezprogową, zalecaną w infekcjach patogenami, funkcję dawka-odpowiedź – (1) (Haas, 1999). Założenia przyjęte dla tej funkcji były następujące: jedna komórka może zainicjować infekcję (brak progu); organizmy są losowo rozmieszczone w porcji (P1-prawdopodobieństwo spożycia organizmu w porcji jest opisane przez rozkład Poissona); istnieje pewne skończone prawdopodobieństwo przejścia każdej bariery w celu pomyślnego zainicjowania infekcji; interakcja żywiciel-patogen jest stała (P2-prawdopodobieństwo związane z tym parametrem jest wartością stałą).
Podpowiedź = 1 – exp(- r × D) (1)
gdzie:
D – dawka infekcyjna
r – parametr funkcji dawka-odpowiedź, który jest interpretowany jako prawdopodobieństwo pomyślnego zainicjowania odpowiedzi (infekcji/choroby itp.) przez jedną komórkę.
Na rysunku 6 przedstawiono wykładniczą krzywą dawka-odpowiedź z różnymi wartościami parametru „r”. Zmiana wartości „r” wykładniczej krzywej dawka-odpowiedź wywołuje przesunięcie krzywej w skali logarytmicznej dawka-odpowiedź. Gdy wartość „r” maleje, krzywa przesuwa się w prawo na skali logarytmicznej dawki, co zgodnie z oczekiwaniami przekłada się na niższe prawdopodobieństwo odpowiedzi (infekcji/zgonu) przy danej dawce. Na przykład przy dawce logarytmicznej 3,0 prawdopodobieństwo wystąpienia choroby przy wartości „r” równej 1e-2 szacuje się na około 100%, podczas gdy przy wartości „r” równej 1e-4 prawdopodobieństwo wystąpienia choroby przy tej dawce szacuje się na około 10%.
W literaturze dostępne są różne modele typu dawka-odpowiedź, w tym: model wykładniczy (Tunis, 1997, Mota i wsp., 2009), model treshold: β-Poisson, złożony β-Poisson(Lim i Jiang, 2013), przybliżony β-Poisson (Petterson i wsp., 2001; van Ginneken i Oron 2000), dwu-parametrowy β-Poison. Ponadto model Weibull-Gamma i model Gompertz”a (Farber i wsp. 1996).
Charakterystyka ryzyka
Charakterystyka ryzyka jest końcowym zadaniem w ocenie ryzyka i zazwyczaj jest etapem procesu, który nadaje kontekst całej wcześniejszej analizie. Etap charakterystyki ryzyka łączy informacje wygenerowane podczas identyfikacji zagrożeń, oceny narażenia i charakterystyki zagrożeń w celu uzyskania pełnego obrazu ocenianego ryzyka. Codex Alimentarius definiuje etap charakterystyki ryzyka jako proces określania jakościowego i/lub ilościowego oszacowania, w tym związanej z tym niepewności, prawdopodobieństwa wystąpienia i dotkliwości znanych lub potencjalnych niekorzystnych skutków zdrowotnych w danej populacji w oparciu o identyfikację zagrożeń, charakterystykę zagrożeń i ocenę narażenia.
Ważne jest, aby pamiętać, że zarządzający ryzykiem powinni określić wynik oceny i rodzaje pytań, na które mają odpowiedzieć osoby oceniające ryzyko na początku procesu oceny. Jednak ocena powinna przynajmniej dążyć do odpowiedzi na następujące pytania w charakterystyce ryzyka:
– Jaki jest charakter i skala ryzyka?
– Które osoby lub grupy są zagrożone?
– Jak poważny jest niekorzystny wpływ lub skutki przy prawdopodobnym narażeniu?
– Jakie są dowody i jak są one mocne?
– Co jest niepewne w odniesieniu do charakteru ryzyka?
– Jaki jest zakres świadomych poglądów na temat charakteru i prawdopodobieństwa ryzyka?
– Jak pewni są oceniający ryzyko co do swoich przewidywań?
Charakterystyka ryzyka powinna również dostarczać informacji na temat charakteru ryzyka, które nie są ujęte w prostym jakościowym lub ilościowym określeniu ryzyka. Takie spostrzeżenia obejmują na przykład opis najważniejszych czynników przyczyniających się do średniego ryzyka, największy wkład w niepewność i zmienność szacowanego ryzyka oraz omówienie luk w danych i wiedzy. Osoba dokonująca oceny ryzyka może również uwzględnić porównanie skuteczności alternatywnych metod redukcji ryzyka do rozważenia przez menedżera ryzyka.
Literatura dostępna u autorki
Elżbieta Rosiak
www.progfood.pl